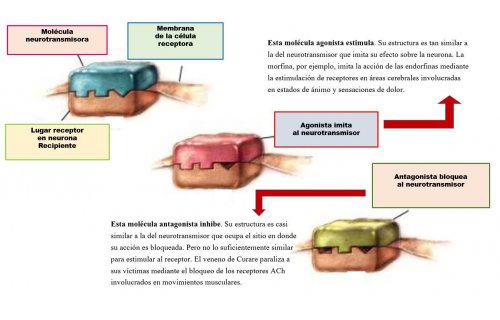
10 clases de enzimas y sus usos en investigaciones
Las enzimas, por su diversidad funcional, están entre las biomoléculas más utilizadas en las investigaciones científicas.
Sus aplicaciones cubren campos tan diferentes como la síntesis de nuevos fármacos, la detección de moléculas nocivas, los ensayos analíticos usados en biotecnología, entre otros.
Aquí encontrará diferentes reactivos para el estudio en ciencias de la vida
Uso de las enzimas en las investigación científica
Las enzimas son moléculas proteicas que catalizan las reacciones que ocurren a nivel celular en los organismos vivos. Estas se clasifican según el sustrato que atacan y la actividad catalítica específica que realizan. Así, por ejemplo, una hidrolasa es aquella enzima que cataliza una reacción de hidrólisis, si la reacción conlleva la ruptura de un enlace peptídico de una proteína esta es llamada proteasa y si cataliza la ruptura de un enlace éster de un lípido se le llama lipasa. Además las enzimas se clasifican según su origen, pueden ser bacterianas, vegetales, animales, etc.
Entre las aplicaciones de las enzimas se encuentran:
- la síntesis orgánica (ej: como biocatalizadores en la síntesis de fármacos)
- en la industria alimenticia (ej: para obtener hidrolizados de proteínas)
- la producción de biocombustibles
- en la industria textil y la producción de detergentes
En la investigación científica siempre se han utilizado enzimas, ya que su uso en procesos industriales data ya es milenario. Actualmente hay una gran demanda de enzimas, pues el desarrollo tecnológico, que hace que aparezcan equipos más sofisticados de análisis, le ha dado un gran impulso a las diferentes ramas de la biomedicina, como es la ingeniería de proteínas, donde el uso de enzimas en indispensable. A continuación se mencionan algunos tipos de enzimas usadas en investigación.
Lipasa B de Candida Antarctica
Las lipasas son las enzimas que catalizan la hidrólisis o ruptura de las grasas. La isoenzima B de Candida Antarctica (CALB) es una de las enzimas más usadas en biocatálisis. Su uso se ha extendido en investigación debido a que su acción no depende de ningún catión metálico (la isoenzima A que produce esta levadura es dependiente de Ca2+), es más estable térmicamente que la mayoría de las lipasas, tiene gran actividad frente a muchos ésteres sintéticos, no se desnaturaliza fácilmente con disolventes orgánicos y lo que es más importante para su uso como biocatalizador, es altamente enantioselectiva sobre numerosos sustratos. Esta enzima es comercializada con el nombre de Novozym 435.
Sorbitol deshidrogenasa
La sorbitol deshidrogenasa o SDH es una enzima que participa en el metabolismo de carbohidratos. Al ser una enzima específica de hígado se utiliza para el diagnóstico diferencial de desórdenes hepáticos. Esta enzima también ha sido investigada por su implicación en la diabetes, su estructura terciaria se utiliza para el diseño de fármacos que mejoren la calidad de vida de pacientes que padecen la enfermedad. Otra rama de la investigación en la que esta enzima se utiliza es en la ingeniería metabólica para la bioproducción de alcoholes.
Penicilín Acilasas
Estas enzimas han sido utilizadas en la investigación de nuevos antibióticos, específicamente para la obtención del núcleo penicilínico 6-APA, a partir del cual se obtienen otras moléculas. Dentro de esta categoría de enzimas entran las que son capaces de hidrolizar la penicilina G, la V y la ampicilina. Son enzimas del tipo nucleófilo hidrolasas N-terminales las cuales sufren un proceso autocatalítico para su activación.
α-Amilasa
La α-amilasa¹ es una enzima que cataliza la ruptura del almidón en azúcares, específicamente promueve la hidrólisis de los enlaces α-1,4-glicosídicos. Esta enzima está presente en la saliva y páncreas humanos, pero también en plantas y algunas bacterias. Es usada en la producción de etanol y otros procesos que requieren la obtención de oligosacáridos como pasos intermedios o productos finales. La α-amilasa llamada “Termamyl," proveniente del Bacillus licheniformis, también se usa en la producción de detergentes. Otra de las aplicaciones más importantes de esta enzima es en la producción de bebidas y licores. Esta enzima ha sido usada como biomarcador en el estudio de diversas enfermedades como la pancreatitis, la diabetes y el cáncer.
Lisozima
La lisozima, también conocida como muramidasa, es una hidrolasa glicosídica que causa daños a nivel celular en numerosas bacterias. Es una enzima que forma parte del sistema inmune en humanos, los niveles bajos de esta enzima están asociados con la incidencia de enfermedades causadas por bacterias comunes como bacilos y micrococos. Las últimas tendencias en la investigación relacionadas con estas enzimas apuntan a la caracterización de los inhibidores de su actividad que han sido encontrados en bacterias y al análisis de carbohidratos.
Acromopeptidasa
La acromopeptidasa es una lisil endopeptidasa, usada para lograr bacteriólisis, especialmente de las bacterias Gram positivas resistentes a la lisozima. Esta enzima puede causar la lisis de estafilococos, estreptococos, Clostridium y leuconóstocos y, además, es activa contra algunos microorganismos Gram negativos. Se usa en investigaciones referentes al aislamiento y la caracterización molecular de bacterias causantes de infecciones en humanos. Actualmente se usa en una gran variedad de ensayos bioquímicos.
β-Galactosidasa de Aspergillus oryzae
La β-galactosidasa es una enzima capaz de hidrolizar los residuos β-D-galactosídicos de diferentes sustratos como disacáridos, oligosacáridos y moléculas glicoconjugadas. La β-galactosidasa proveniente del hongo Aspergillus oryzae es una de las más utilizadas con fines investigativos. Esta enzima es usada en la síntesis de moléculas prebióticas (galacto-oligosacáridos o GOS), en la biosíntesis de diferentes productos transgalactosilados, en pacientes con intolerancia a la lactosa (su capacidad de hidrolizar la lactosa se aprovecha en la producción de lácteos deslactosados que pueden consumir estos pacientes) y en diferentes ensayos analíticos.
β-Lactamasas
Las β-lactamasas son enzimas producidas por algunas bacterias que ofrecen resistencia frente a los antibióticos β-lactámicos como la penicilina. Este tipo de enzimas se usa tanto en la investigación de nuevos antibióticos como en la ingeniería de proteínas. Se utilizan para obtener proteínas, mediante la fusión de polipéptidos, con aplicaciones en campos como el análisis bioquímico, la purificación de proteínas, la inmunodetección, el desarrollo de vacunas, entre otros. Además, las β-lactamasas son de gran interés para la fusión de proteínas a la proteína fluorescente verde (GFP), que se ha convertido en una de las herramientas más importantes en los estudios biomédicos.
Endoproteinasa Glu-C.
La endoproteinasa Glu-C es una proteasa usada para el anclaje selectivo de proteínas en la determinación de la secuencia de aminoácidos de las proteínas. Esta proteasa se une por los residuos acídicos de los péptidos con carboxilos provenientes de ácido glutámico o aspártico, la especificidad de la misma depende del buffer que se use para el análisis. Su uso más frecuente es en análisis proteómico, para la digestión de proteínas, en muestras que van a ser analizadas por electroforesis, por espectrometría de masas o para incrementar la selectividad de las columnas de afinidad usadas en la purificación de fosfopéptidos, ya que se une a las proteínas por el residuo acídico y hace que los péptidos formados durante el proceso de purificación no interfieran en la misma.
Termozimas (enzimas de los organismos termófilos)
Las termozimas han generado mucho interés en los últimos años debido a su utilización en la obtención de biocombustibles. Su capacidad de catalizar reacciones en condiciones extremas y su alta estabilidad frente a reactivos químicos que desnaturalizan a otros tipos de enzimas, determinan su uso en la industria de la biocatálisis. Con el uso de las termozimas se puede trabajar a temperaturas mayores que las usuales en los procesos biocatalíticos, y con un aumento en la solubilidad de las sustancias involucradas en los procesos, es por esto que numerosas síntesis orgánicas que se llevaban a cabo con otras enzimas están siendo revisadas para la introducción de termozimas.